原子力システム 研究開発事業 成果報告会資料集
電解還元法を適用した酸化物燃料の乾式再処理に関する技術開発
(研究代表者)坂村義治 原子力技術研究所 上席研究員
(再委託先)独立行政法人日本原子力研究開発機構、国立大学法人京都大学
1.研究開発の背景とねらい
金属燃料高速炉と乾式再処理から成る金属燃料サイクルは、次世代の有望な高速炉システムとして高い評価を受けている。一方、軽水炉の燃料は酸化物であるため、将来、金属燃料サイクルに移行していくためには、軽水炉サイクルの酸化物燃料を原料として受け取り、金属形態に還元して金属燃料サイクルに供給するプロセスが必要である。簡素なプロセスが特徴である電解還元法は、その最有力候補である。
図1に、電解還元法を適用した酸化物燃料の再処理プロセスの概要を示した。「①前処理」では、使用済燃料を脱被覆して電解還元用の陰極容器に装荷するが、この過程で、高温処理によりセシウム(Cs)など一部の核分裂生成物(FP)を揮発分離することも可能である。「②電解還元処理」の原理は、次式で表される。
LiCl溶融塩中での電解により、陰極に装荷された酸化物から酸素がイオンとなって溶融塩中に溶出し、酸化物は金属に還元される。一方、陽極では酸素ガスが放出される。マイナーアクチニド元素(MA)は、ウラン(U)やプルトニウム(Pu)と共に金属に還元されて回収され、FPの内、Csやストロンチウム(Sr)は溶融塩中に溶解して分離される。「③電解精製処理」は、電解還元処理で回収された還元物から残留するFPを取り除くと共に、Pu富化度を調整するために行う。
電解精製における電極反応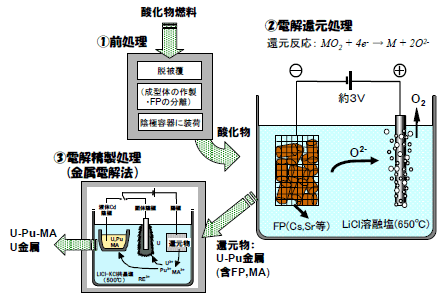
図1 電解還元法を適用した酸化物燃料の乾式再処理プロセス
ここでは、LiCl-KCl溶融塩中で還元物を陽極として電解し、固体陰極でU金属を、液体カドミウム陰極でU-Pu-MA合金を回収する。その過程で、不純物のFPは陽極に残留あるいは溶融塩中に溶解して分離される。
電解還元処理において、これまでの研究でU,Pu,MAが酸化物から金属に還元されることが実証されている1-3)。将来この電解還元を核燃料再処理技術として実用化するためには、MAやFPの挙動を詳細に調べてプロセスの最適化を図ること、陰極での酸化物還元速度を向上させること、実用的な陽極を開発すること、前処理/電解還元/電解精製の一連プロセスの実証などが現段階では重要である。本研究では、それら課題の解決に取り組み、次段階である使用済燃料試験や実規模試験に繋げて行く。
2.研究開発成果
2.1 電解還元処理における酸化物還元速度の向上
電解還元技術を実用化するためには、処理速度が十分に大きいことが不可欠である。本研究開発では、実規模として想定している1バッチ当り5〜10kgの酸化物を、10時間以内で金属に還元できる技術を確立することが1つの目標である。そこで、酸化物の還元速度を向上させるために、酸化物を装荷する陰極容器の形状と、酸化物原料の形態に関して、研究を行った。
電解還元試験で用いた電解槽の概略を図2に示す。LiClに約1wt%のLi2Oを加えた溶融塩を直径10cmのステンレスるつぼに入れ、中央にUO2を装荷した陰極バスケットを、その周囲に3つの白金陽極を配置した。陽極の白金板は周囲をマグネシアさや管で囲い、電解中に発生する酸素ガスを上部から排気した。その他に、リチウム-ビスマス合金の参照極と熱電対を溶融塩中に挿入した。温度は、650℃(LiClの融点:606℃)とした。
図3(a)に、90gのUO2粉末を装荷した陰極バスケットの写真を示した。円皿状のバスケットを3段に積み重ねた形状である。電解は、初期には15Aで行い、還元の進行に伴って設定電流を徐々に下げていった。そして、観測される陰極電位が、リチウム金属の電位を示す様子から判断し、8.4時間後に電解を終了した(酸化物が還元されるとリチウム金属が陰極に析出し始める)。電解後の陰極バスケット断面を観察した結果、図3(c)に見られるように、UO2は完全に金属ウランへ還元されていることが確認された。これまでの研究結果から、陰極に装荷するUO2粉末の層が厚い場合には、完全に還元するために長時間を要することが分かっており、図3(a)の陰極バスケット形状が適切であることが実証された。陰極バスケットの径を大きくし、かつ段数を増やせば、実規模に拡張することは容易であると考えられる。
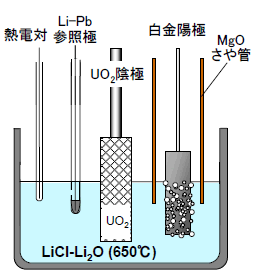
図2 電解還元槽の概略

図4 溶融LiCl中での多孔質性UO2ペレットの電解還元試験
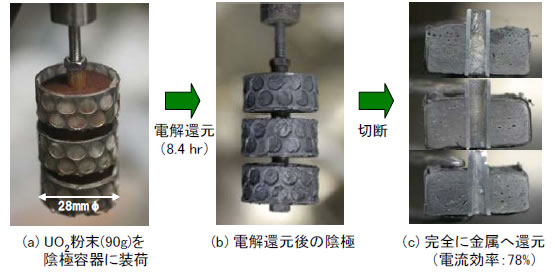
図3 溶融LiCl中でのUO2粉末の電解還元試験
酸化物原料形態に対する試みとして、あらかじめ多孔質性のUO2ペレットを焼結し、円筒形の陰極バスケットに104g装荷した(図4(a))。UO2ペレットは、直径7mm×高さ10mmで、気孔率は約30%である。電解は、同様に15Aで開始して、還元の進行に伴って設定電流を徐々に下げ、9.3時間後に終了した。図4(b)には、電解後のバスケット内の様子と、ペレットの断面を示した。全てのUO2ペレットが金属に還元されていることが確認され、電流効率は62%であった。多孔質性のUO2ペレットは、ペレット自体の内部に溶融塩が浸透しやすいこと、目の粗い金網で陰極容器を作製できること、バスケット内に溶融塩の流路が確保されることなどから、溶融塩を介した酸素の排出が促進され、酸化物還元速度の向上に効果的であることが示された。
以上、実規模で酸化物を10時間以内に還元するという目標を達成できる見込みが示された。
2.2 電解還元処理におけるFP挙動の解明:アルカリ金属およびアルカリ土類金属FPの影響
2.1でも示されたように、UO2は溶融LiCl中で比較的容易に金属へ還元される。ところが、使用済燃料を処理すれば、溶融塩中にアルカリ金属およびアルカリ土類金属FPが溶解して蓄積する。そこで、溶融塩組成が電解還元に及ぼす影響を調べることを目的とした研究を行った。
まず、LiCl-CsCl系で塩組成をパラメータとしたUO2電解試験を実施した。図5に電解装置の概略を示した。UO2電極は、半円板状のUO2片をニッケル線で固定して作製した。対極には白金板、参照極にはLi-Bi合金を用いた。図6には定電位電解時(Li金属電位に対して+0.02Vに設定)の電流変化を示した。電流は、電解開始直後にUO2表面が還元されて電子電導性が向上することにより増大し、やがてUO2還元の反応面が試料内部に移行していくに従って減少した。1.5時間後に電解を終了し、試料断面を観察した(図7)。UO2は電解につれて周囲から還元されるが、その進行速度はCsCl組成の増大とともに著しく低下することが明らかになった。LiCl中では中心部まで金属に還元されたが、LiCl-30mol%CsCl中では表面の約0.05mmが還元されたに過ぎない。
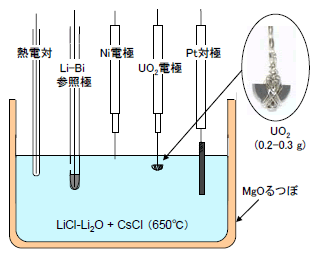
図5 UO2電解還元試験で用いたセル
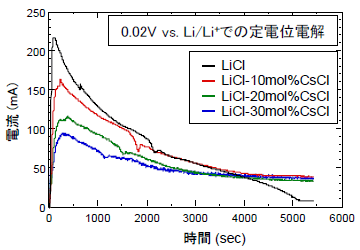

他の系でも同様の還元試験を行ったところ、LiCl-KCl系はLiCl-CsCl系と類似した結果であった。アルカリ土類金属の場合、LiCl-SrCl2系では、SrCl2組成を増大してもUO2の還元速度の低下は見られなかった。LiCl-BaCl2系ではUO2の還元速度は少し低下した。
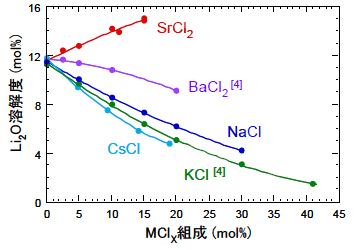
そこで、還元速度の決定因子を調べるために、溶融LiCl-MClx系(Mは、Na,K4),Cs,Ca,Sr,Ba4))でLi2O溶解度を測定した。その結果、図8に示されるように、溶融LiCl中にアルカリ金属のNaCl、KCl、CsClを加えるとLi2O溶解度は大きく低下し、その効果は原子番号が大きい元素ほど著しいことがわかった。アルカリ土類金属の場合には、Li2O溶解度はBaCl2を添加すると比較的緩やかに低下し、SrCl2では逆に増加した。また、CaCl2を添加すると、CaOが沈殿した。
以上の結果から、酸化物の還元速度は溶融塩中のLi2O溶解度に大きく影響されることが明らかとなった。これは、Li2O溶解度が低下すると、O2-が酸化物内部からバルク塩中に排出されづらくなるためと考えられる。FP元素中ではCsの影響が大きく、SrやBaの影響はほぼ無視できる。
3.今後の展望
3.1 再処理プロセス連続試験
図1の再処理プロセスに対応し、出発物質としてUO2を約100g用いた前処理/電解還元処理/電解精製処理の連続試験を行い、精製された金属ウランが回収できることを既に実証している5)。今後、模擬使用済燃料(UO2に代表的なFPを添加した酸化物)を用いた連続試験を行い、各元素の化学形態と物質収支を調べて、プロセス全体の成立性を評価する。更に電解還元については、0.5-1.0kg規模までスケールアップした準実規模UO2試験を実施し、還元技術の実用性を示す。
3.2 実用的陽極の開発
電解還元の陽極では、溶融塩中のO2-が酸化されてO2ガスとして排出される。従来の試験では、陽極材料として主に白金と炭素が用いられてきたが、より実用的な陽極を開発するために、新たな導電性酸化物などを対象に、耐食性が高く、O2ガスが効率よく発生する非消耗性陽極材料を選び出すことを目的に研究を行っている。これまでに、鉄フェライト系の電極材料について適用可能性を見い出すことができた5)。今後、他の材料についても検討を行い、O2ガス発生の電流密度や耐久性能に関して比較評価し、実用性に優れた陽極材料を選定する。
3.3 アクチニド元素およびFP挙動の解明
本研究開発において、これまでにPu酸化物の溶融LiCl-Li2O中への溶解度測定を実施した6)。今後、Am酸化物について同様の測定を完了し、アクチニド酸化物の溶解度データを整備して、高回収率を達成できる条件の解明に資する。
また、主要なFPである希土類元素に関して、3.1で得られる結果と、これまでに取得した基礎的な電気化学測定および吸光分光測定7)等の結果を総合して、還元や溶解の挙動を明らかにする。
3.4 プロセスの最適化検討
本研究開発の成果に基づき、酸化物燃料の乾式再処理プロセスフローを最適化して、各元素の物質収支を提示すると共に、発生が想定される廃棄物の種類や処理法などを検討する。そして、プロセス全体の成立性を評価する。
4.参考文献
1) Y.Sakamura, M.Kurata and T.Inoue, J. Electrochem. Soc., 153 (3), D31-D39 (2006).
2) M.Iizuka, Y.Sakamura and T.Inoue, J. Nucl. Mater., 359, 102 (2006).
3) Y.Sakamura, T.Omori and T.Inoue, Nucl. Technol., 162, 169 (2008).
4) 「平成17年度 文部科学省 革新的原子力システム技術開発公募事業 酸化物燃料の電解還元処理に関する技術開発」成果報告書、電力中央研究所、平成18年3月
5) 坂村義治、「電解還元法を適用した酸化物燃料の乾式再処理に関する技術開発」、原子力システム研究開発事業成果報告会〔資料集〕、P.124-127、科学技術振興機構、平成20年1月
6) T.Kato, Y.Sakamura, T.Iwai and Y.Arai, submitted for publication in Radiochim. Acta.
7) T.Fujii et al., Proc. 8th International Symposium on Molten Salts Chemistry & Technology (MS8), p.962, 19-23 Oct. 2008, Kobe, Japan.

